イベニティ皮下注105mgシリンジ
国内副作用報告の集積状況及び適正使用のお願い
(収集期間:2019年3月4日~2021年3月7日)
2 重要な潜在的リスク
2.1 重篤な心血管系事象
販売開始(2019年3月4日)から2021年3月7日までに、64例68件の虚血性心疾患、120例130件の脳血管障害の副作用が報告されました。
出荷数量から算定した推定累積投与患者数*を用い、販売開始から1年間、販売開始1年後から1年間、及び販売開始から2年間における曝露期間で調整した100人年あたりの虚血性心疾患及び脳血管障害の報告率を算出しました(表3)。なお、製造販売後において収集された有害事象情報は自発報告であり、臨床試験からの情報とは異なり本剤を処方されている患者の背景因子が異なること、実際に本剤を投与された累積投与患者数を正確に把握することは困難であるため、本剤の出荷数量から算定した推定投与患者数を使用していることにご留意ください。
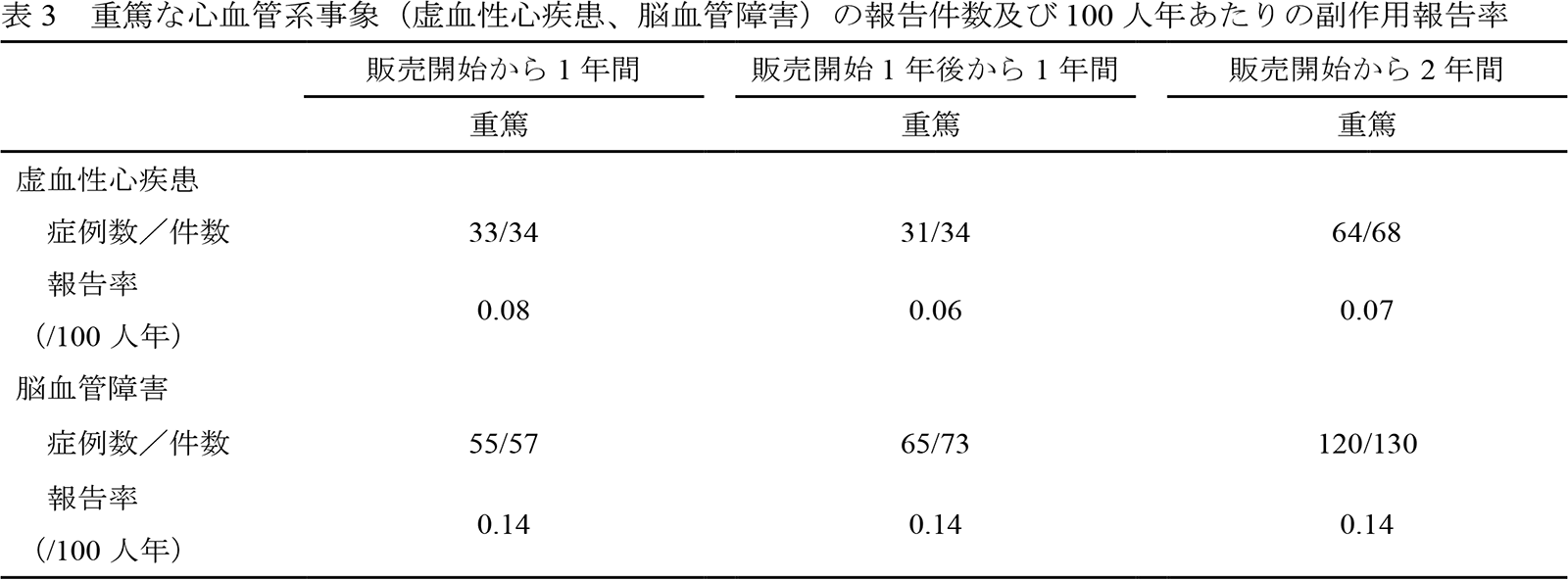
販売開始から1年間:2019年3月4日~2020年3月7日
販売開始1年後から1年間:2020年3月8日~2021年3月7日
販売開始から2年間:2019年3月4日~2021年3月7日
虚血性心疾患は「虚血性心疾患SMQ」MedDRA ver.23.1を使用して抽出した。
脳血管障害は「中枢神経系出血および脳血管性疾患SMQ」MedDRA ver.23.1を使用して抽出した。
*出荷数量から算定した推定累積投与患者数(人年)
販売開始から1年間(2019年3月~2020年2月):39349.9人年
販売開始1年後から1年間(2020年3月~2021年2月):48065.9人年
販売開始から2年間(2019年3月~2021年2月):87415.8人年
推定累積投与患者数(人年)は、投与開始した患者が標準的な投与量で1年間投与継続したと仮定した場合の推定の患者数です。
【参考値】
製造販売後において収集された自発報告における報告率と、臨床試験や調査において収集された発現率を直接比較することはできません。参考値として示しております。
100人年あたりの心筋梗塞、脳卒中の発現率:
・本剤の臨床試験成績(20070337試験、20110142試験)から推定された100人年あたりの発現率(Amgen社内資料)
心筋梗塞:0.3、0.8、脳卒中:0.2、0.7
・公表論文での日本人骨粗鬆症患者集団と一般的な日本人集団の両方での100人年あたりの発現率
心筋梗塞:0.11a)1)、0.13a)2)、0.17a)2)、脳卒中:0.31b)3)、0.36a)4)、0.40a)4)、0.51a)5)
a) 一般的な日本人集団 b) 日本人骨粗鬆症集団
引用文献
1) Nakamura M, et al, 2017. Circ J 2017;81:1854-61
2) Rumana et al, 2008. Am J Epidemiol 2008;167:1358-1364
3) Urushihara et al, 2009. Menopause. 2009;16(5):971-7
4) Takashima et al, 2017. Circ J 2017;81:1636-1646
5) Ishikawa S et al, 2008. Epidemiol 2008;18:144-150
【留意して頂きたい事項】
添付文書の「警告」、「効能又は効果に関連する注意」、「重要な基本的注意」、「特定の背景を有する患者に関する注意」及び「その他の注意」に重篤な心血管系事象に関する注意が記載されています。また、医療従事者向けRMP資材「イベニティの適正使用について」において、重篤な心血管系事象の対策が記載されています。
① 添付文書の記載
イベニティ皮下注105mgシリンジ添付文書(抜粋)(2020年8月改訂、第1版)
1. 警告
海外で実施されたアレンドロン酸ナトリウムを対照とした比較試験において、心血管系事象(虚血性心疾患又は脳血管障害)の発現割合がアレンドロン酸ナトリウム群に比較して本剤群で高い傾向が認められている。また、市販後において、本剤との関連性は明確ではないが、重篤な心血管系事象を発現し死亡に至った症例も報告されている。
本剤の投与にあたっては、骨折抑制のベネフィットと心血管系事象の発現リスクを十分に理解した上で、適用患者を選択すること。
また、本剤による治療中は、心血管系事象の発現がないか注意深く観察するとともに、徴候や症状が認められた場合には速やかに医療機関を受診するよう指導すること。[5.1、5.2、8.3、9.1.1、15.1.1、17.1.1-17.1.3参照]
5. 効能又は効果に関連する注意
5.1 本剤の適用にあたっては、日本骨代謝学会・日本骨粗鬆症学会の診断基準における以下の重症度に関する記載等を参考に、骨折の危険性の高い患者を対象とすること。[1.参照]
・骨密度値が-2.5SD以下で1個以上の脆弱性骨折を有する
・腰椎骨密度が-3.3SD未満
・既存椎体骨折の数が2個以上
・既存椎体骨折の半定量評価法結果がグレード3
5.2 本剤の投与にあたっては、本剤のベネフィットとリスクを十分に理解した上で、適用患者を選択すること。[1.、8.3、9.1.1、15.1.1、17.1.1-17.1.3参照]
8. 重要な基本的注意
8.3 本剤を投与する場合には、虚血性心疾患及び脳血管障害の徴候や症状を患者に説明し、徴候や症状が認められた場合は、速やかに医療機関を受診するよう指導すること。[1.、5.2、9.1.1、15.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚血性心疾患又は脳血管障害のリスクが高い患者
虚血性心疾患又は脳血管障害のリスクが高い患者への投与は、本剤の骨折抑制のベネフィットと心血管系事象の発現リスクを考慮して判断すること。少なくとも、過去1年以内の虚血性心疾患又は脳血管障害の既往歴のある患者に対して、本剤の投与は避けること。[1.、5.2、8.3、15.1.1、17.1.1-17.1.3参照]
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施されたアレンドロン酸ナトリウムを対照とした比較対照試験(4054例)の二重盲検期(12ヵ月間)において、心血管系事象による死亡、心筋梗塞、及び脳卒中の発現割合はアレンドロン酸ナトリウム群に比較して本剤群で高い傾向が認められた(心血管系事象による死亡:本剤群17例(0.8%)及びアレンドロン酸ナトリウム群12例(0.6%)、心筋梗塞:本剤群16例(0.8%)及びアレンドロン酸ナトリウム群5例(0.2%)、脳卒中:本剤群13例(0.6%)及びアレンドロン酸ナトリウム群7例(0.3%))。一方、国際共同第Ⅲ相プラセボ対照比較試験(7157例:日本人489例を含む)の二重盲検期(12ヵ月間)では、心血管系事象による死亡、心筋梗塞、及び脳卒中の発現割合はプラセボ群と本剤群で同程度であった(心血管系事象による死亡:本剤群17例(0.5%)及びプラセボ群15例(0.4%)、心筋梗塞:本剤群9例(0.3%)及びプラセボ群8例(0.2%)、脳卒中:本剤群8例(0.2%)及びプラセボ群10例(0.3%))。[1.、5.2、8.3、9.1.1参照]
② RMP医療従事者向け資材「イベニティの適正使用について」の記載
イベニティ皮下注105mgシリンジ「イベニティの適正使用について」(抜粋)(2020年8月印刷)
重篤な心血管系事象の対策
[注意が必要な患者]
◆ 心血管系事象(虚血性心疾患または脳血管障害)の発現リスクが高い患者。少なくとも、過去1年以内の心血管系事象の既往歴のある患者に対して、イベニティの投与は避けること。
◆ 心血管系事象治療中の患者、あるいはこれらの発現リスクが高い疾患の治療中の患者
[患者への指導内容]
◆ イベニティ投与中に胸痛、冷汗、意識低下、意識消失、片側の手足のしびれなどの症状が認められた場合には速やかに医療機関を受診すること。
◆ 心血管系事象発現のリスクが高い患者に対し、イベニティ投与による重篤な心血管系事象のリスクを理解させ、患者の家族の支援のもと、早期発見、早期受診すること。
◆ 心血管系事象発現時に、医療従事者へイベニティ投与の情報を確実に提供するために、イベニティの患者カードを携帯、提示すること。
虚血性心疾患または脳血管障害を発症するリスクは、心筋梗塞または脳卒中などの発現後早期に高く、その再発リスクは経時的に低下することが心血管系事象発症後の予後を検討した国内外の疫学データからも認められています。
心血管系事象発現のリスクが高い患者への投与は、イベニティの骨折抑制のベネフィットと心血管系事象の発現リスクを考慮して、慎重に判断してください。特に、他の医療機関にて、虚血性心疾患または脳血管障害の治療中、あるいはこれらの発現リスクが高い疾患の治療中である場合には、互いに連携し、処方の必要性を慎重に判断してください。
心血管系事象について、患者向け資材(患者カード)を作成し、配布しています。
ROM214001IS9(2023年3月作成)

