イベニティ皮下注105mgシリンジ
国内副作用報告の集積状況及び適正使用のお願い
(収集期間:2019年3月4日~2021年3月7日)
1 重要な特定されたリスク
1.1 過敏症
販売開始(2019年3月4日)から2021年3月7日までに、216例225件の過敏症関連の副作用が報告されました。このうち、重篤な副作用は「多形紅斑」、「薬疹」、「発疹」、「過敏症」、「スティーヴンス・ジョンソン症候群」、「結節性紅斑」、「水疱性皮膚炎」、「皮膚炎」、及び「免疫性血小板減少症」の11例11件でした。非重篤な過敏症関連の主な副作用は「発疹」、「蕁麻疹」、「湿疹」、「薬疹」、「注射部位発疹」及び「歯肉腫脹」でした。
出荷数量から算定した推定累積投与患者数*を用い、販売開始から1年間、販売開始1年後から1年間、及び販売開始から2年間における曝露期間で調整した100人年あたりの過敏症関連副作用の報告率を算出しました(表1)。なお、製造販売後において収集された有害事象情報は自発報告であり、臨床試験からの情報とは異なり本剤を処方されている患者の背景因子が異なること、実際に本剤を投与された累積投与患者数を正確に把握することは困難であるため、本剤の出荷数量から算定した推定投与患者数を使用していることにご留意ください。
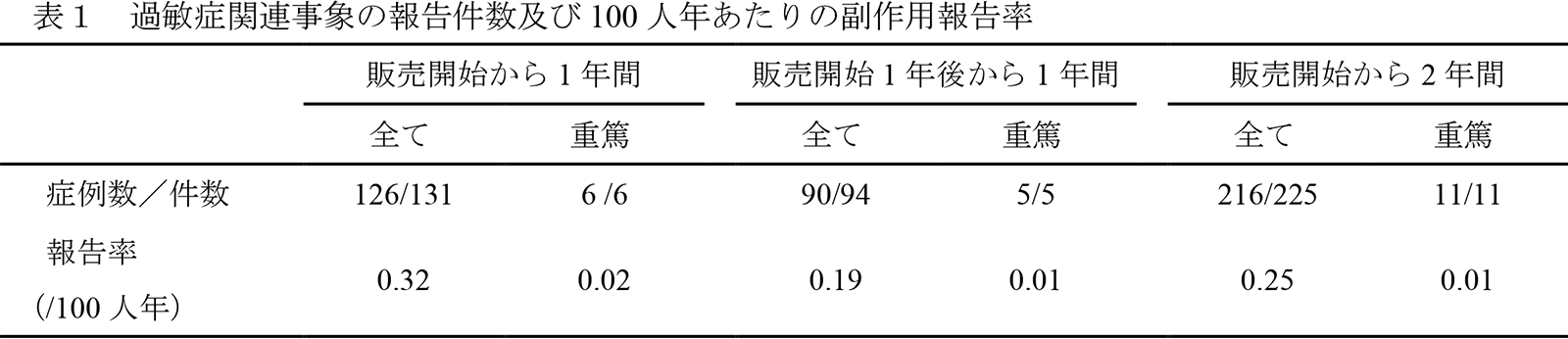
販売開始から1年間:2019年3月4日~2020年3月7日
販売開始1年後から1年間:2020年3月8日~2021年3月7日
販売開始から2年間:2019年3月4日~2021年3月7日
過敏症関連事象は「過敏症SMQ」MedDRA ver.23.1を使用して抽出した。
*出荷数量から算定した推定累積投与患者数(人年)
販売開始から1年間(2019年3月~2020年2月):39349.9人年
販売開始1年後から1年間(2020年3月~2021年2月):48065.9人年
販売開始から2年間(2019年3月~2021年2月):87415.8人年
推定累積投与患者数(人年)は、投与開始した患者が標準的な投与量で1年間投与継続したと仮定した場合の推定の患者数です。
【留意して頂きたい事項】
添付文書の「禁忌」に「本剤の成分に対し過敏症の既往歴のある患者」が記載されています。また、「その他の副作用」に過敏症が記載されています。
① 添付文書の記載
イベニティ皮下注105mgシリンジ添付文書(抜粋)(2020年8月改訂、第1版)
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
11.2 その他の副作用
過敏症(発疹、皮膚炎、蕁麻疹、血管浮腫、多形紅斑等)(1%未満)
ROM214001IS9(2023年3月作成)



 でログイン
でログイン